Nas últimas décadas tem havido um interesse crescente relativamente ao contributo das alterações vasculares no desenvolvimento e progressão do glaucoma.
À semelhança da retina, o suprimento arterial do nervo óptico (NO) provém das artérias coroideias (região pré-laminar e lâmina cribrosa, sensíveis ao sistema nervoso autónomo) e de pequenos ramos da artéria central da retina (região superficial), sem inervação pelo sistema nervoso autónomo (SNA)1. Desta forma, é expectável, que uma regulação normal do fluxo sanguíneo ocular (FSO) seja fundamental para manter o NO saudável. Esta regulação é mediada através de diversos sistemas, tais como a camada de células endoteliais, hormonas circulantes e SNA.
Estudos recentemente publicados, demonstraram que os doentes com glaucoma primário de ângulo aberto (GPAA) desenvolvem mais frequentemente doença cardíaca isquémica comparativamente a doentes sem glaucoma2,3. Adicionalmente, doentes com diabetes mellitus tipo 2 (DM2) e hipertensão arterial parecem ter maior risco de NOG4,5. Estes achados encontram-se provavelmente relacionados, com a presença de um insulto vascular contínuo que poderá contribuir para o compromisso da vascularização sistémica.
Teoricamente, esta agressão vascular ao nível do NO pode ter um papel importante no desenvolvimento e progressão da neuropatia óptica glaucomatosa (NOG), quer pelas suas características anatómicas, nomeadamente a ausência de barreira hematoencefálica íntegra, quer pela maior susceptibilidade de lesão axonal mecânica dependente de PIO elevada, ao nível da lâmina cribrosa(6).
O papel dos fatores de risco vascular na NOG vai de encontro aos resultados descritos no Blue Mountains Eye Study7, que demonstrou que o estreitamento arterial retiniano é um fator de risco para glaucoma de ângulo aberto. Adicionalmente, a análise da coriocapilar peripapilar através de OCT-angio em doentes com GPAA revelou, em cerca de 50% dos casos, a presença de áreas de diminuição da densidade dos plexos microvasculares profundos, com correspondência topográfica na diminuição da camada de fibras nervosas peripapilar8. Tal pode traduzir um evento primário na NOG, uma vez que a coriocapilar não é diretamente responsável pelo suprimento dos tecidos superficiais do NO. No entanto, é necessário considerar a hipótese deste achado ser apenas um efeito secundário da lesão glaucomatosa preexistente (diminuição da densidade vascular pela redução das necessidades metabólicas do NO)8.
Ainda assim é de salientar que na literatura a associação entre os fatores de risco cardiovasculares e o risco de desenvolvimento de GPAA é ainda controversa9. Tal facto pode dever-se à compensação do insulto vascular crónico, pelos mecanismos auto-reguladores do fluxo sanguíneo. Nos doentes que apresentem esses mecanismos atenuados ou disfuncionais e incapazes de compensar as alterações negativas no FSO, o limiar para a ocorrência de NOG pode estar reduzido. O glaucoma normotensional (GNT) é um exemplo da implicação desta agressão vascular contínua na NOG6,10,11.
A desregulação vascular (DV) é a incapacidade dos vasos dilatarem ou contraírem em resposta às demandas metabólicas, como a hiperperfusão, mas principalmente a hipoperfusão, resultando em lesão tecidular. A DV encontra-se associada ao GTN, onde já se comprovou que a presença de uma diminuição da tensão arterial (TA) durante o sono, superior ao normal (over-dipping) é um fator de risco para NOG10. Os doentes com GNT tendem a ter mais sintomas relacionados com alterações vasculares do que os doentes com GPAA, tais como hipotensão arterial, enxaqueca ou fenómeno de Raynaud12,13.
A DV é classificada comoprimária (DVP) ou secundária (DVS), podendo esta última ser secundária a doenças neurológicas ou inflamatórias, tais como a esclerose múltipla ou arterite de células gigantes10.
A síndrome da disfunção vascular primária ou Síndrome de Flammer (SF), descreve um grupo de sinais e sintomas resultantes de uma resposta vascular anormal a estímulos considerados normais, tais como o frio, stresse emocional e exercício físico e que está presente mesmo em indivíduos jovens e saudáveis1. Os sintomas tendem a aparecer na puberdade e a diminuir com a idade. Estes incluem sensação de frio das extremidades, TA baixa, baixo peso corporal, sensação reduzida de sede, enxaqueca, tinnitus, sensibilidade aumentada à dor, melhor percepção olfativa do que a população normal, tempo de início do sono mais longo, entre outros14.
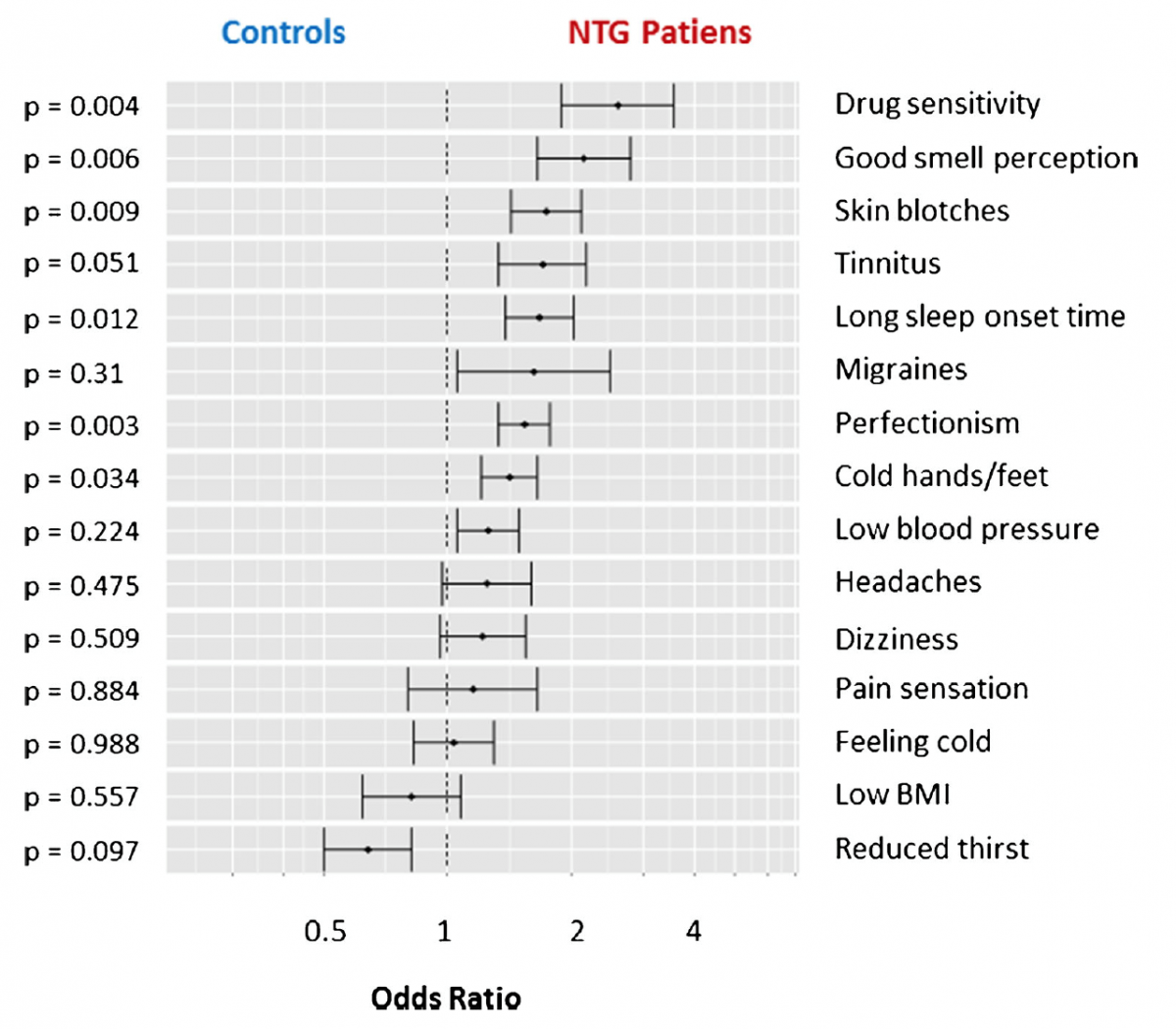
Figura 1: Adaptado de Konieczka et al, 2017 (14). Frequência de sinais e sintomas da Síndrome de Flammer em doentes com GNT versus grupo controlo.
Não existe um exame auxiliar de diagnóstico padrão para a SF, permanecendo o seu diagnóstico essencialmente clínico. Embora seja predominantemente benigna, a SF predispõe os doentes a doenças oculares como o desenvolvimento e a progressão de GNT ou a obstrução arterial e venosa da retina11.
Está descrito que doentes com retinite pigmentosa e GNT, apresentam mais frequentemente sintomas da SF do que a restante população14,15 e que os doentes com GNT e SF tendem a apresentar TA baixa14,16. Esses dados demonstram a existência de um substrato fisiológico comum entre essas duas entidades.
Na SF a flutuação do FSO e o suprimento instável de oxigénio ocorrem especialmente quando há flutuação da TA e da PIO(6). Esta variabilidade do FSO surge devido a vários fatores, como o vasoespasmo, a disfunção endotelial (um regulador fundamental da homeostasia micro e macrovascular) e o stresse oxidativo6. É considerada a hipótese da existência de uma disfunção primária do endotélio, com um desequilíbrio a favor da produção de endotelina-1 (ET1) em relação ao óxido nítrico, reduzindo o FSO6.
Adicionalmente, a incapacidade de auto-regulação vascular é responsável pela instabilidade de perfusão do NO, o que leva a alterações isquémicas transitórias e lesões de reperfusão leves, que culminam no aumento do stresse oxidativo e aumento da produção local de ET16. Além de demonstrada a importância do aumento da ET1 na SF, esta molécula encontra-se também aumentada em doentes com GNT16. Esta substância vasoativa liga-se aos recetores de ET presentes nas células do músculo liso e perícitos, aumenta o cálcio citoplasmático e induz a vasoconstrição que afeta a circulação do NO (desprovida de barreira hematoencefálica)17. O stresse oxidativo induz, ainda, a expressão de metaloproteinases (ex.MMP-9), a lesão mitocondrial das células ganglionares com disfunção da produção de energia (fundamental no transporte axonal) e a ativação de células da glia, nomeadamente os astrócitos1. Em conjunto, estes eventos induzem uma alteração no microambiente do NO, responsável pela lesão axonal.

Figura 2: Termografia da face e mãos (Adaptado de Grieshaber et al 2007 10.
A análise termográfica permite avaliar o padrão de distribuição da temperatura corporal (termografia). Imagens à esquerda: controlo; imagens à direita: doente com DVP, apresentando diminuição da temperatura da face e extremidades.
Devido às alterações vasculares inerentes aos doentes com GNT é necessário considerar outras terapêuticas não dependentes da redução da PIO, a qual, apesar de fundamental no controlo de outros tipos de glaucoma, no GNT poderá não ser suficiente para a progressão da doença.
A promoção de alterações no estilo de vida são medidas teoricamente úteis, no entanto o seu impacto ao nível da perfusão do NO é ainda desconhecido18.
Foi demonstrado que a função endotelial pode melhorar com a prática de exercício físico e a suplementação com flavonoides (vinho, chá, cacau), pela ação antioxidante dos polifenóis18. De forma semelhante, a Ginkgo biloba, demonstrou melhorar a FSO e os defeitos campimétricos nos doentes com GNT19. Tentar corrigir a hipotensão sistémica com o aumento do aporte de sal e prevenir o over-dipping noturno, pode ser importante neste tipo de doentes20.
Existe pouca evidência na literatura acerca da regulação vascular farmacológica nos doentes com GNT. Os bloqueadores dos canais de cálcio em baixa dose, reduzem o efeito da ET1 e assim a vasoconstrição, sendo importante a monitorização clínica apertada, por forma a não induzir reduções adicionais da TA15. A utilização combinada de timolol/dorzolamida parece aumentar o FSO no NO21,22adicionalmente à redução da PIO.
Em conclusão, a SF é caracterizada por uma disfunção vascular primária, cuja principal característica é a desregulação do tónus vascular, sabendo-se que é factor de risco para GNT. É assim necessário prosseguir na investigação de medidas adicionais que permitam estabilizar o FSO, melhorando a perfusão do NO, de forma a melhor tratar o GNT.



